소아응급실에서 항생제 사용 원칙
Principles of antibiotic therapy in pediatric emergency department
Article information
Trans Abstract
Infectious diseases are among the most common conditions seen in pediatric emergency departments. Of these, in bacterial infections, appropriate antibiotic therapy should be started quickly. Specific antibiotic therapy is optimally driven by microbiologic diagnosis, predicated on isolation of the pathogenic organism, and supported by antimicrobial susceptibility testing. However, given the inherent difficulties that can arise in collecting specimens from pediatric patients, and given the high risk of mortality and disability associated with serious bacterial infections in very young infants, much of pediatric infectious disease practice is based on a clinical diagnosis with empirical use of antibacterial agents. Therefore, it is important to know the age-appropriate differential diagnosis with respect to likely pathogens. This information affects the choice of antimicrobial agent and also the dose, dosing interval, and route of administration. The patterns of antimicrobial resistance in the community and for the potential causative pathogen being empirically treated must also be considered. Antimicrobial resistance has reached crisis proportions, driven by the emergence of new resistance mechanisms and by overuse of antibiotics. It is important for practitioners to use antibiotics only as necessary, with the narrowest feasible antimicrobial spectrum, to help thwart emergence of resistance.
서 론
소아에서 급성 감염성 질환은 매우 다양하고 흔하게 나타나며, 그 원인은 대부분 바이러스지만, 항생제 요법이 반드시 필요한 세균감염도 종종 발생한다. 이러한 경우, 적절한 항생제를 신속하게 투여하는 것이 증상 완화와 질병 완치에 있어서 가장 중요한 요소이다. 그러나, 항생제의 무분별한 사용은 부작용과 의료 비용의 증가는 물론, 주요 세균들의 항생제 내성을 증가시켜, 향후 지역사회에서 감염성 질환을 조절하는 것을 더욱 어렵게 만들 수 있다. 특히 면역이 약한 어린 영아나 노인, 항암치료 중인 환자 등 고위험군에서는 감염성 질환이 주요 사망 원인으로 작용하게 된다[1].
응급실은 초기에 소아 세균감염 환자를 접하는 곳으로서, 여기서 결정된 경험적 항생제 요법이 초기 치료의 적절성을 결정하고 이후에도 유지되는 경우가 많기 때문에, 응급실에서의 항생제 선택은 아주 중요하다[2]. 따라서 본 종설에서는 응급실 차원에서 급성 감염성 질환으로 방문한 소아에서 적절한 항생제를 사용하기 위한 기본 원칙 및 최신 지견에 대해 다루고자 한다.
본 론
1. 감염성 질환의 원인균
감염성 질환은 대개 그 원인균에 따라 진단 및 치료 방침을 세우게 된다. 기존의 역학 연구에서 알려진 주요 감염성 질환의 흔한 원인균에 대한 지식을 바탕으로, 초기 대처, 즉 경험적 항생제 요법을 결정하게 된다[1]. 감염성 질환의 원인균은 크게 바이러스, 세균, 진균, 기생충 등으로 나눌 수 있다. 이 중 기저질환이 없는 건강한 영/유아 및 소아/청소년의 감염성 질환은 대부분 바이러스에 의해 발생하며, 감염 경로는 주로 호흡기 분비물에 의한 점막 감염이거나 분변-구강 경로이므로, 호흡기 및 위장관 감염이 가장 흔하게 일어난다. 주요 호흡기 바이러스에는 rhinovirus, coronavirus, adenovirus, respiratory syncytial virus, metapneumovirus, influenza virus, parainfluenza virus 등이 있고, 위장관 바이러스에는 rotavirus와 norovirus가 있다[3]. 잘 알려진 바와 같이 바이러스 감염에서는 항생제가 전혀 도움이 되지 않으며, influenza virus나 herpes simplex virus, varicella zoster virus 등 일부 바이러스 감염에서만 항바이러스제를 선택적으로 사용하고 있다[1].
한편 진균감염은 주로 면역저하자 또는 장기입원 환자에서 발생하며, Candida albicans와 Aspergillus fumigatus가 가장 흔한 원인균으로, 이러한 진균감염 시에는 amphotericin B, fluconazole, voriconazole 등의 항진균제를 사용하게 된다[4]. 가끔 해외 또는 국내 위험지역에서 획득된 말라리아 감염이 심한 경과를 밟을 수 있으나, 우리나라와 같은 선진국에서 기생충이 큰 문제가 되는 경우는 흔하지 않다.
따라서 응급실 차원에서 소아의 급성 감염성 질환의 치료에 있어 가장 중요한 사항은 바로 다양한 세균감염에 대해 적절한 항생제를 선택하는 것이다. 우선 감염성 질환에서 흔히 접하는 세균을 대략적으로 호기성 그람 양성균, 호기성 그람 음성균, 그리고 혐기성균으로 나눌 수 있고, 여기에 속하지 않는 세균 중 특히 소아의 지역사회 감염에서 중요한 세균으로 Mycoplasma가 있다. 이중 호기성그람 양성균으로서 대표적인 것은 Staphylococcus와 Streptococcus이다. Staphylococcus는 다시 coagulase 양성인 S. aureus와 coagulase 음성인 coagulase-negative staphylococci (CoNS)로 나뉜다. S. aureus 와 가장 대표적인 CoNS인 S. epidermidis가 항생제감수성검사 상 oxacillin(또는 cefoxitin)에 내성을 보이는 경우를 각각 methicillin-resistant S. aureus (MRSA), methicillin-resistant S. epidermidis (MRSE)라고부른다(Fig. 1) [5].
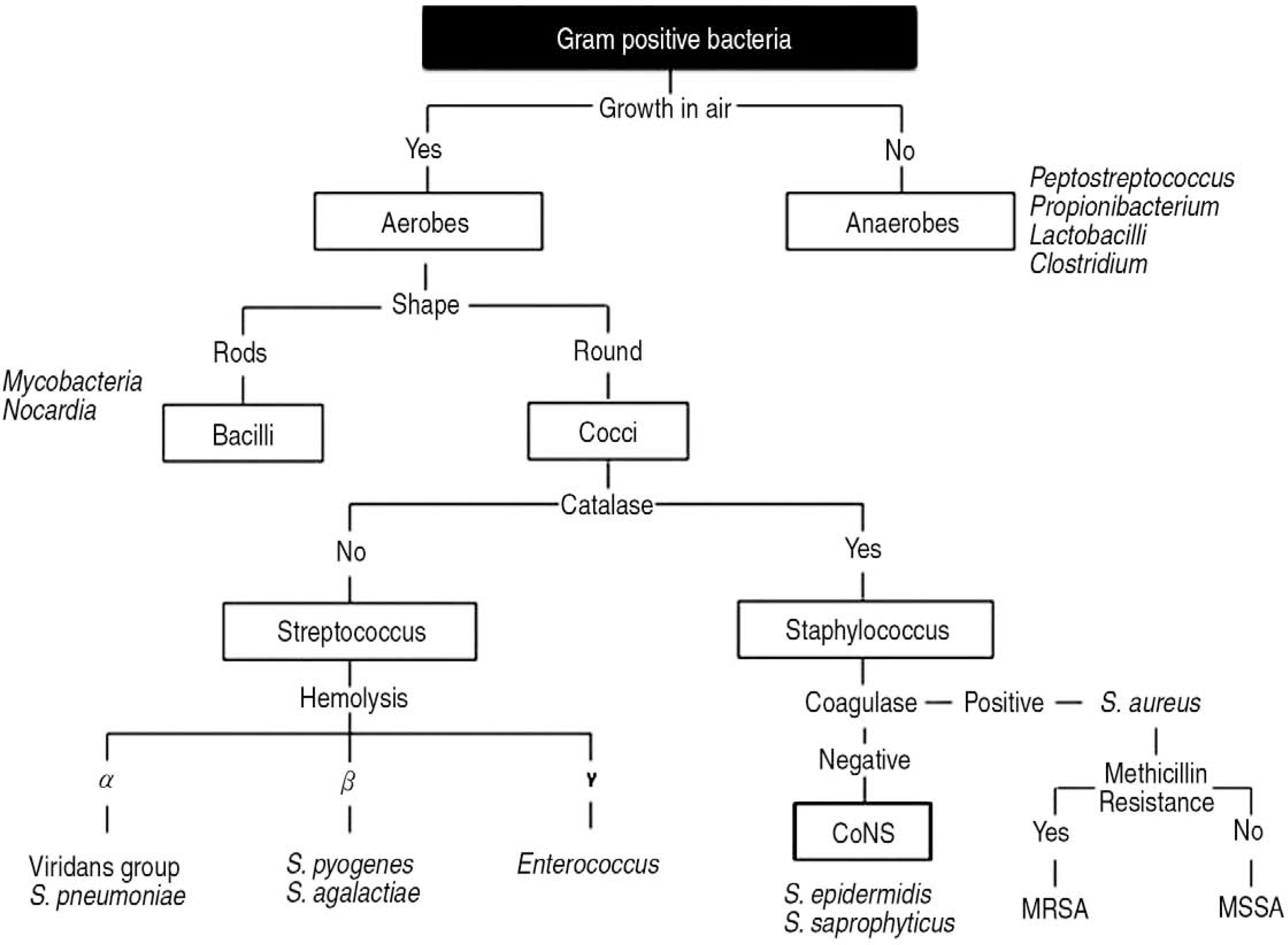
Classification of clinically important gram positive bacteria. CoNS: coagulase-negative staphylococci, MRSA: methicillin-resistant Staphylococcus aureus, MSSA: methicillin-susceptible Staphylococcus aureus.
Streptococcus에는 그 용혈성과 생화학적 성상에 따라 S. pyogenes (group A streptococcus, GAS), S. agalactiae (group B streptococcus, GBS), S. pneumoniae (pneumococcus), Enterococcus faecium/faecalis 등이 포함된다. 이중 GAS는 편도염과피부-연조직 감염의 흔한 원인균이며, GBS는 신생아 패혈증 및 수막염의 흔한 원인균이다. Pneumococcus는 폐렴, 중이염, 부비동염 등의 호흡기 감염은 물론, 패혈증 및 수막염의 흔한 원인이기도 하다. Enterococcus는 주로 만성 질환자나 면역저하자에서 위장관을 비롯한 다양한 부위에 감염을 일으킬 수 있는데, 이 중 vancomycin에 내성인 enterococci (vancomycin-resistant enterococci)를 VRE라고 부르며, 그 치료 및 내성 전파에 있어서 매우 중요하게 다루어진다(Fig. 1) [5].
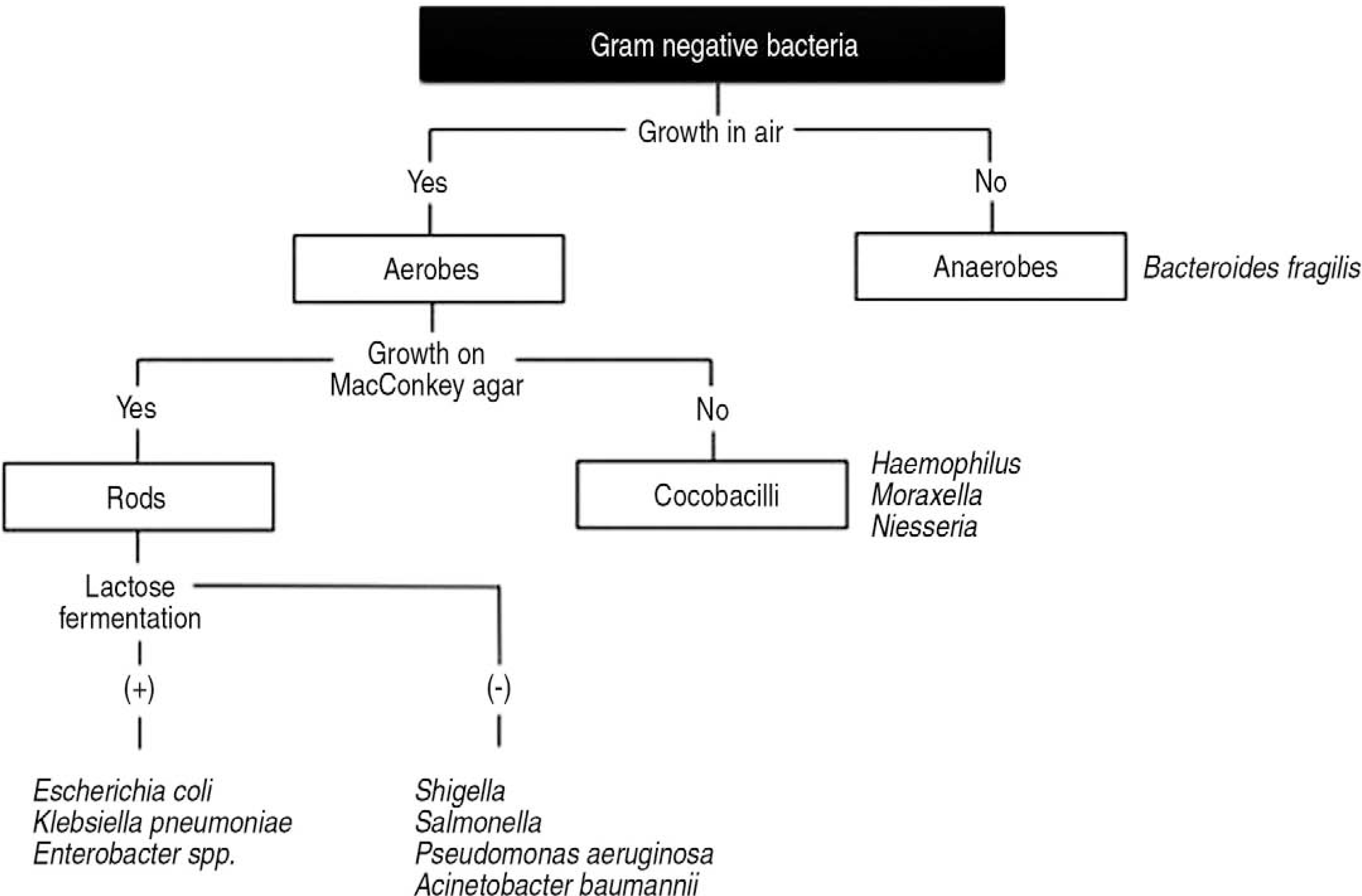
호기성 그람 음성균에는 주로 호흡기에 존재하는 coccobacilli와 주로 장내에 존재하는 rods가 있다. 호흡기 감염성 그람 음성 coccobacilli에는 Haemophilus influenzae와 Moraxella catarrhalis가 대표적이다. 장내 그람 음성 세균에는 젖당 분해능이 있는 Escherichia coli, Klebsiella pneumoniae, Enterobacter species 등과, 젖당 분해능이 없는 Salmonella, Shigella, Pseudomonas aeruginosa, Acinetobacter baumannii 등이 있다(Fig. 2). 젖당 분해균들은 주로 위장관 및 요로에 감염을 일으키고, 비분해균들은 주로 세균성 장염과 연관되거나 병원관련 위험인자를 가지고 있는 환자들에서 패혈증, 폐렴, 복강 내 감염 등을 일으킨다[5].
한편 혐기성균은 다양한 구강 내 세균과 장내 세균이 있으며, 병독성이 약해서 일반적으로는 감염을 잘 일으키지 않으나 역시 만성 질환자나 면역저하자 등 병원관련 위험인자가 있는 환자에서 주로 감염을 일으키고, 특히 구강 및 복부 수술 후 감염과 연관된다. 마지막으로 Mycoplasma는 특이하게도 세포벽이 없는 세균이며, 주로 학동기 연령에서 기관지염, 폐렴 등의 하부호흡기 감염의 주된 원인이 된다[5].
2. 항생제의 종류
감염성 질환에 대하여 임상에서 흔히 쓰는 항생제에는 β-lactam, aminoglycoside, glycopeptide, quinolone, tetracycline, macrolide 계열 등이 있다[6]. 이 중 β-lactam 계열의 항생제가 성인은 물론, 소아에서도 가장 많이 쓰는 항생제로, 크게 penicillin, cephalosporin, 그리고 carbapenem의 세 종류로 분류된다. 이 중 penicillin과 cephalosporin 계열의 항생제들이 외래와 응급실, 입원환자에서 경구용 및 주사용으로 가장 많이 사용되고 있고, carbapenem은 고위험군에서 약제 내성 균에 대하여 주사용으로 사용하고 있다(Table 1).
Penicillin은 다시 정맥주사용 penicillin-G, 근육주사용 benzathine penicillin, 경구용 penicillin-V, amino-penicillin, anti-staphylococcal penicillin, anti-pseudomonal penicillin, β-lactamase inhibitor (BLI) 포함 penicillin 등으로 나눌 수 있다. 이 중 경구용 penicillin-V를 제외한 모든 약제는 2015년 12월 현재 국내에서 사용 가능하다. Penicillin은 항균범위는 좁지만 항균력이 매우 강력하여, 대부분의 Streptococcus 감염에서 선택적 항생제로 사용된다. 항생제의 항균범위와 항균력은 전혀 별개이므로 이를 혼동해서는 안 된다[6]. 예를 들어, vancomycin은 MRSA를 비롯하여 대부분의 그람 양성균에 작용하지만 결코 강한 항생제는 아니다.
S. aureus는 penicillinase (β-lactamase의 일종)를 생성할 수 있게 되면서 penicillin에 대부분 내성을 가지게 되었다. Methicillin, oxacillin, nafcillin 등은 이러한 penicillinase에 저항성을 갖도록 만든 합성 penicillin으로, methicillin이 간질신장염의 부작용 빈도가 높아서 시장에서 퇴출된 이후, 임상에서는 주로 nafcillin이 사용되고 있다. MSSA에는 nafcillin이 가장 강력한 선택적 항생제이다[6].
Amino-penicillin은 penicillin에 아민기를 붙여서 부작용을 줄이고 생체이용률을 향상시킨 항생제이다. Amino-penicillin은 현재 penicillin과 거의 대체 가능한 항생제로 사용되고 있으나, GAS, GBS, pneumococcus에 대해서는 penicillin에 비해 활성이 약간 떨어지고, S. aureus에 대해서는 nafcillin에 비해 활성이 떨어진다. 대표적인 amino-penicillin에는 ampicillin과 amoxicillin이 있으며, 둘 다 주사용과 경구용이 있지만 주로 ampicillin은 주사용, amoxicillin은 경구용으로 쓰인다. 특히 amoxicillin은 경구투여 시 흡수율이 대단히 좋기 때문에, ampicillin 경구 제제를 거의 사용하지 않으며, 경구용 penicillin-V의 대체 항생제로도 사용된다. 특히 그람 양성균 중 Enterococcus과 Listeria는 cephalosporin 계열의 항생제에는 저항성을 보이므로 amino-penicillin이 선택적 항생제이다[6].
그람 양성 호기성균은 물론, 그람 양성 혐기성균에도 대개 penicillin 계열의 항생제를 단독으로 사용할 수 있다. 그러나 많은 그람 음성균들은 β-lactam 항생제를 분해할 수 있는 β-lactamase를 생성하며, 따라서 penicillin 제제 단독으로 사용하지 않고 BLI가 포함된 복합제제를 사용한다. 대표적인 항생제에는 amoxicillin-clavulanate, ampicillin-sulbactam, piperacillin-tazobactam 등이 있다. 보통 횡격막 위쪽의 혐기성균은 Peptostreptococcus 등의 그람 양성균이 많고, 횡격막 아래쪽의 혐기성균은 Bacteroides fragilis 등의 그람 음성균이 많기 때문에, 특히 복강 내 감염 등에서 혐기성균 감염을 고려할 때에도 BLI가 포함된 복합제제를 주로 사용하게 된다. Piperacillin은 Pseudomonas에 항균력을 갖는 대표적인 β-lactam 계열의 항생제로, 대부분의 그람 양성, 음성, 혐기성 세균에도 효과를 보이는데, β-lactamase를 생성하는 그람 음성 세균은 저항성을 보일수도 있으므로 piperacillin-tazobactam을 사용한다[6].
Cephalosporin은 개발 시기에 따라 1세대부터 5세대까지 분류할 수 있다. 일률적으로 적용되는 것은 아니지만, 세대가 증가할 수록 항균범위는 넓어지면서 항균력은 그람 양성균에서 그람 음성균으로 증가하는 추세를 보인다. 우선 1세대 cephalosporin은 Staphylococcus와 Streptococcus에 주로 사용하는 항생제이다. Penicillin이나 nafcillin에 비해서는 항균력이 약간 낮은 편이며, 중추신경계 이행은 거의 안 된다. 주사용으로 cefazolin이 쓰이며, 경구용으로 cephradine과 cephalexin이 주로 쓰인다. 2세대 및 3세대 cephalosporin은 그람 양성균에 대한 항균력은 줄었지만, 대다수의 그람 음성균에 항균력을 보이도록 개발되었다. 다만, 그람 양성균 중 penicillin-resistant S. pneumoniae (PRSP)에 대해서는 2, 3세대 cephalosporin도 좋은 항균력을 보인다. 따라서 2, 3세대 cephalosporin은 주로 지역사회 획득성 폐렴이나 요로감염 등에 경험적 항생제 요법으로 많이 쓰이고 있다. 2세대에는 대표적으로 cefuroxime이 있고, 3세대에는 주사용 ceftriaxone, cefotaxime과 경구용 cefdinir, cefpodoxime, cefditoren 등이 있다. 3세대 cephalosporin은 그람 양성균에도 대부분 좋은 항균력을 보이지만, 1세대 cephalosporin이 경구흡수율, 생체이용률 등에서 월등하므로, 특히 피부-연조직 감염에서는 경구용으로 1세대 대신 3세대 cephalosporin은 쓰지 않는것이 바람직하다[6].
한편, 2세대 cephalosporin 중 cefoxitin, cefotetan, flomoxef 등을 따로 cephamycin 계열로 분류하며, 이들은 특히 장내 혐기성균에 좋은 항균력을 보여 복부골반계 감염에 주로 사용된다. Piperacillin과 같이 Pseudomonas에 효과가 있는 cephalosporin이 3세대 중 ceftazidime과 4세대의 cefepime으로서, 이들은 기본적으로 대부분의 그람 음성균들에도 좋은 항균력을 가진다. 그러나 cefepime이 대부분의 그람 양성균에도 매우 우수한 항균력을 보이는 반면, ceftazidime은 그람 양성균에 대한 항균력은 미미하다. 마지막으로 항균범위에 MRSA까지 포함된 ceftaroline이 5세대 cephalosporin으로 분류된다[6].
그람 음성균들이 보유하고 있는 β-lactamase 중 특히 광범위하게 대부분의 β-lactam에 내성을 보이는 효소들이 존재하는데, 이것이 바로 extended-spectrum β-lactamase (ESBL)이다. ESBL도 보통은 BLI에 의해서 억제될 수 있기 때문에 ESBL 생성균에 의한 감염에서 β-lactam+BLI 복합제제를 고려해 볼 수 있다. 하지만, 많은 경우에 ESBL 생성균이 BLI에 의해 억제되지 않는 AmpC β-lactamase를 같이 생산하므로, 결국 carbapenem 계열의 항생제를 사용하게 된다[6].
Aminoglycoside 계열의 항생제들은 주로 그람 음성균에 항균력을 가지며, β-lactam 계열의 항생제와 병합요법 시에는 상승효과를 보이는 것으로 알려져 있다. Quinolone 및 tetracycline 계열의 항생제는 각각 연골 및 골 발달 저해, 치아 착색 등의 부작용 우려로 소아에서 사용되지 않았다. 그러나 지금까지 축적된 연구결과들로부터 이러한 부작용의 빈도가 매우 낮고 일시적인 것으로 알려져, 최근에는 꼭 필요한 경우 소아에서도 사용이 고려되고 있다. 두 항생제 모두 그람 양성, 음성 균은 물론 Mycoplasma에도 효과가 있는 광범위 항생제이다. Glycopeptide 계열에는 vancomycin과 teicoplanin이있으며, MRSA 및 MRSE 감염에서 사용하고, 특히 S. pneumoniae에 의한 수막염에도 사용된다. 마지막으로, Macrolide 계열의 항생제는 Mycoplasma pneumoniae, Chlamydia pneumoniae/trachomatis, Bordetella pertussis 감염의 선택적 항생제로 사용되며, 호흡기 감염의 주요 원인균인 S. pneumoniae 및 H. influenzae 에도 사용될 수 있으나, 국내에서는 현재 S. pneumoniae 는 내성이 매우 높고 H. influenzae에는 비교적 감수성이 높게 유지되고 있는 것으로 알려져 있다[6].
3. 감염 질환 별 항생제의 선택
1) 호흡기 감염
(1) 편도염, 인두염
대부분은 바이러스 감염이며, 일부에서 GAS가 원인이 된다[7]. Centor criteria 등의 임상적 판단 또는 GAS에 대한 신속항원검사, 인두배양검사 등을 통해 의심 또는 진단이 되면 항생제를 사용한다[8]. GAS는 penicillin에 매우 높은 감수성을 유지하고 있고 경구용 penicillin-V가선택적 항생제이지만 국내에 없으므로, 대신 경구용 amoxicillin 단독으로 하루 50 mg/kg의 용량을 10일 사용한다. 불충분한 치료 시 심경부 감염 등의 급성 화농성 합병증이나 류마티스열 등 장기 비화농성 합병증의 발생 가능성이 있으므로 증상이 빨리 호전되더라도 치료를 충분히 유지해서 완료하도록 한다[9].
(2) 중이염, 부비동염
기본적으로 세균감염이므로 진단이 되면 항생제를 투여한다. S. pneumoniae, H. influenzae, M. catarrhalis가 주요 원인균이다[10–12]. S. pneumoniae는 GAS와 마찬가지로 β-lactam 항생제를 단독으로 사용하는데, PRSP인 경우 일반 용량(40–50 mg/kg/d)으로는 효과가 적을 수 있다. 우리나라와 같이 PRSP의 비율이 높은 경우 주로 고용량(90 mg/kg/d) 요법을 쓰도록 권고된다. H. influenzae와 M. catarrhalis는 그람 음성균으로서 많은 경우에 β-lactamase를 분비하므로, amoxicillin에 BLI가 포함된 amoxicillin-clavulanate나 2, 3세대 cephalosporin을 사용한다. 그러나 S. pneumoniae에 대한 cephalosporin의 감수성이 지역사회마다 다양하고 점차 내성이 증가하는 추세이기 때문에, 결국 중이염과 부비동염에서 선택적 항생제로 가장 추천되는 것은 고용량 amoxicillin-clavulanate 요법이다[13,14].
(3) 폐렴
영아 및 어린 소아에서는 대부분 바이러스가 원인이지만, 일부에서 세균성 폐렴이 발생할 수 있다. 중이염 및 부비동염과 마찬가지로 S. pneumoniae와 H. influenzae가 흔하며 GAS, S. aureus도 일부에서 원인이 될 수 있다. 따라서 심하지 않은 지역사회 획득성 폐렴인 경우 고용량 amoxicillin (또는 amoxicillin-clavulanate) 요법을 사용하고, 심한 경우에는 입원해서 주사용 ampicillin (또는 ampicillin-sulbactam)을 사용하게 된다[15]. 한편 학동기 연령의 소아에서 M. pneumoniae가 흔한 폐렴의 원인이므로 유행시기이거나 임상적으로 의심 시에는 macrolide 계열 항생제인 clarithromycin, roxithromycin, azithromycin을 사용한다[16].
2) 경부 농양
대부분 GAS에 의한 감염이고 구강 내 정상균무리인 viridans group streptococcus, 그람 양성 혐기성균 등이 일부에서 관여한다[17]. β-lactam 항생제가 유효하여 amoxicillin 또는 ampicillin으로 충분하지만, 일부 혐기성 균이 β-lactamase를 형성할 수 있어서 주로 치과문제로부터 발생한 심한 경부 농양의 경우에는 ampicillin-sulbactam을 사용한다[18].
3) 복부 감염
설사 및 구토를 동반하는 위장염은 대부분 바이러스 감염이고, 세균성 장염에서도 항생제가 반드시 필요한 경우는 드물다. Shigella와 Salmonella에 의한 심한 위장염이나 E. coli, K. pneumoniae 등에 의한 충수염, 복막염 등 복강 내 감염에서는 2, 3세대 cephalosporin을 주로 사용한다[19]. 복강 내 감염에서 Clostridium perfringens, B. fragilis 등의 혐기성균을 고려하여 metronidazole이나 clindamycin을 추가하기도 한다. 특히 의료기관 관련감염에서 P. aeruginosa가 의심될 때에는 piperacillin-tazobactam 또는 ceftazidime을 사용하며, 이들은 대부분의 장내 그람 음성균과 혐기성균에도 항균력을 갖는다[20].
4) 요로감염
E. coli와 K. pneumoniae가 흔하므로 주로 2, 3세대 cephalosporin이 추천되나, 이 약제의 사용이 ESBL의 상승과 관련 있으므로 장내 세균들에 역시 우수한 항균력을 갖는 piperacillin-tazobactam을 추천하기도 한다. ESBL 생성균인 경우에는, 만약 3세대 cephalosporin이나 piperacillin-tazobactam으로 초기 경험적 치료가 임상적으로 효과가 있다면 그대로 치료를 유지하고, 치료반응이 없는 경우에는 carbapenem, 특히 ertapenem으로(P. aeruginosa가 아닌 경우) 변경한다[21]. 급성신우신염의 경우 임상적으로 안정된 후 경구용 항생제로 전환할수 있고, 연장아에서 방광염이나 요도염과 같은 하부 요로감염인 경우에는 초기부터 경구용 항생제를 시도해 볼 수 있는데, 이 때에는 주로 3세대 cephalosporin(특히 cefixime, cefpodoxime 등)이나 trimethoprim-sulfamethoxazole을 사용한다[22]. 소아에서는 비교적 드물지만 Enterococcus로 인한 요로감염이 발생한 경우 cephalosporin 계열 항생제에 내성을 보이므로, 감수성에 따라 ampicillin이나 vancomycin을 사용한다.
5) 피부 및 연조직 감염
S. aureus와 GAS가 대부분이므로 1세대 cephalosporin인 cefazolin이나 nafcillin을 사용하고, 경한 경우에는 경구용으로 cephradine이나 cephalexin을 사용한다. MRSA일 때에는 주사용 vancomycin이 필요할 수 있으나, 심하지 않은 경우에는 대부분 적절한 절개배농 만으로도 호전되고, clindamycin이나 trimethoprim-sulfamethoxazole에 감수성이면 이들 제제를 경구로 사용할 수 있다[23].
6) 패혈증
신생아 및 3개월 미만의 영아에서는 E. coli, GBS가 흔하므로 경험적 항균요법은 ampicillin과 gentamicin의 병합요법으로 한다. 그 이상의 연령에서는 S. pneumoniae, H. influenzae, Salmonella, S. aureus 등이 흔하므로 vancomycin과 cefotaxime의 조합을 우선 투여한다. 특히 병원 관련 인자를 가지고 있거나 중심정맥카테터를 장기간 유지하고 있는 고위험군 소아에서는 MRSA에 의한 catheter related blood stream infection이 흔하므로, vancomycin의 조기 사용을 고려한다[24].
7) 수막염
원인균이 패혈증과 거의 동일하므로 패혈증에서의 경험적 항균요법을 그대로 따른다. 다만, aminoglycoside의 혈액뇌장벽 투과력이 미약하므로, 3개월 미만의 영아에서 세균성 수막염 의심 시에는 gentamicin 대신 cefotaxime을 투여한다[25].
결 론
소아 세균감염에 대한 적절한 치료에 있어서 가장 중요한 요소는, 응급실에서 경험적 항생제를 선택하는 것이다. 항생제 선택은 ‘의심 질환 → 해당 질환의 흔한 원인균 →해당 원인균에 대한 적절한 항균범위 → 감염성 질환의 진단적 확실성과 중증도에 따른 항생제의 항균력 고려’의 흐름으로 이루어진다. 따라서 세균감염에 있어서는 그 진단법 못지 않게 원인균의 역학과 각 항생제의 항균범위 및 항균력에 대한 지식이 중요하다. 감염성 질환의 중증도가 높고 진단이 확실할수록 항균범위는 좁으나 항균력이 강한 항생제를, 중증도가 낮고 진단이 불확실할수록 항균력이 약하더라도 항균범위가 넓은 항생제를 사용하게 된다. 중증도도 높고 진단도 불확실한 경우에는 항균력이 강한 항생제와 항균범위가 넓은 항생제를 병합해서 사용하기도 한다. 여기서 중요한 것은, 항균범위와 항균력은 항상 일치하지는 않는다는 점이다. 소아 세균감염에 대한 일차 방어선인 응급실에서 더욱 적절한 항생제의 선택이 이루어지기를 기대한다.